
최근 계속되는 러시아-우크라이나 전쟁으로 전세계 식탁 물가가 위협받고 있습니다. 러시아의 해상 봉쇄, 그리고 미사일 공격에 노출된 육로가 모두 막히면서 우크라이나의 곡물 2천2백만 톤 이상이 저장고에 쌓여 있다고 합니다. 러시아와 우크라이나는 세계 밀 시장에서 21.5%의 점유율을 차지하는 주요 밀 수출국인데요, 사정이 이렇다보니 국제 시장에서는 밀 가격이 무려 60%가 상승했습니다.
엎친데 덮친 격으로, 세계 밀 생산량 2위국인 인도마저도 50도를 넘나드는 이상 폭염현상으로 밀생산이 줄어 수출을 긴급 금지하기에 이르렀는데요, 전문가들은 오는 7월경 세계적인 곡물 부족 사태가 현실화될 것이라는 전망을 내놓고 있습니다.
기본적인 생명 유지활동에 빨간 불이 켜진 전 지구적 비상사태라 할 수 있는데요, 지금으로부터 200년 전에도 인류가 굶어 죽을 위기에 처했던 때가 있었다고 합니다. 당시엔 어떤 일이 있었고, 인류는 이 위기를 어떻게 극복할 수 있었을까요?
01
대규모 기아 위기에 처한 19세기의 인류

근대 과학기술과 의료기술의 발달은 영유아 사망률 감소, 그리고 수명 연장이라는 인류의 꿈을 실현하면서 19세기부터 전세계 인구가 폭발적으로 증가하게 됩니다. 영국의 경제학자였던 토마스 맬서스(Thomas Malthus)는 1798년 <인구론>이라는 저서를 통해 “인구는 기하급수적으로 증가하나 식량은 산술급수적으로 증가하므로 인구와 식량 사이의 불균형은 필연적이다.”라는 주장을 하며 이는 곧 인류의 기근과 빈곤을 가져올 것이라는 경고를 합니다.
당시의 농업기술로는 생산할 수 있는 식량에 한계가 있었기 때문에, 맬서스를 비롯한 사람들은 인구 억제의 필요성에 공감했으며, 실제로 영국은 저소득층 인구를 줄이기 위해 빈민 복지예산을 대폭 감축하기도 하지요.
또한 영국의 화학자였던 윌리엄 크룩스(William Crookes) 역시 영국 과학아카데미의 신임 원장 취임 연설에서 “인류는 1930년대에 대규모 기아사태를 맞이” 할 것이라며 과학자들을 향해 “화학만이 인류를 구원”하게 될 것이니 비료의 화학적 합성법을 개발할 것을 공개적으로 요청했답니다.
그러나19세기 초 10억명이던 세계인구는 현재 80억명에 육박할 만큼 단기간 내 크게 증가했는데요, 이렇듯 인류를 먹여 살려 굶주림의 공포에서 해방시킬 수 있었던 배경 뒤에는 하버-보슈법이 있었답니다.
02
‘결속은 나의 무기!’ 단단히 결합한 질소 기체

인류의 주식량이 되는 곡물은 주로 탄소(C), 수소(H), 산소(O), 질소(N)로 이루어져 있어서 식물이 빠르게 성장하기 위해서는 토양에 이 네 가지의 구성요소가 영양분으로 공급되는 것이 중요합니다. 이중 탄소, 수소, 산소는 자연에서도 쉽게 얻을 수 있지만, 질소는 그렇지 않습니다.
공기 중에 약 80%를 차지할 정도로 흔한 성분임에도 질소를 충분히 얻지 못하는 건, 질소 기체가 질소 원자 두개의 삼중결합 구조로 된 매우 안정한 분자이기 때문입니다. 이는 다른 말로 하면 결합이 너무 단단하고, 화학 반응성이 낮아서 식물이 질소를 이용하기가 어렵다는 뜻입니다. 그래서 화학 반응성이 높은 다른 질소 화합물인 암모니아를 이용하게 되는데요, 암모니아는 동물의 분뇨에 풍부하게 들어있기 때문에 말똥과 같은 배설물을 비료로 주기 시작합니다.
하지만 배설물에는 소량의 질소만이 포함되어 있어서 곡물을 대량 생산할 정도의 충분한 양이 확보하기는 어려웠습니다. 그래서 많은 과학자들이 암모니아를 인공적으로 합성해 비료로 사용할 수 있도록 하는 방법을 연구하게 됩니다.
03
이 온도, 압력, 그리고 철 촉매… 완벽한 조건 발견!

질소 합성법 개발이 어려웠던 이유는 수소와 질소를 아무리 섞어도 서로 반응하지 않기 때문이었는데요, 독일의 화학자인 프리츠 하버(Fritz Haber)는 질소 기체와 수소 기체를 반응시켜 암모니아를 만드는 기초적인 화학 반응식을 이용합니다.
N2 + 3H2 → 2NH3
아주 간단한 이론과는 달리 이 반응은 발열반응에 해당하여 ‘르 샤틀리에 법칙’이 적용되기 때문에 암모니아를 얻기가 쉽지 않았습니다. 질소 분자의 강력한 삼중결합을 깨기 위해서는 높은 온도를 가해야 하지만, 르 샤틀리에 법칙에 따르면 온도를 높일수록 역반응이 우세해져 암모니아를 얻기가 쉽지 않았던 것이죠. 그러나 암모니아를 많이 얻기 위해 온도를 낮추면 반응 속도가 느려져 대량 생산에 적절치 않다는 딜레마가 존재했습니다.
*화학계의 청개구리 법칙! 르 샤틀리에 법칙이란?
[과학의 법칙] 오늘날 화학 공법의 필수! 르 샤틀리에 법칙 알아보기
안녕하세요, 블로그 지기입니다. 세상에는 많고 많은 과학의 법칙, 원리 그리고 공식이 존재합니다. 1884년, 프랑스 화학자 르 샤틀리에는 현대 화학 공법의 필수라고 하는 ‘화학 평형 이동의 법
www.chemi-in.com
하버 박사는 반응속도를 촉진하기 위한 고온, 고압 환경을 조성하면서도 온도를 너무 높여 역방향 우세반응이 극심해지지 않는 정도의 균형 조건을 찾기 위해 무수히 많은 촉매와 원소를 조합하고 복잡한 실험 과정을 거치게 됩니다. 그리고는 철 촉매를 사용하여 약 200기압, 4~500°C가 암모니아를 만드는 최적의 방식임을 발견해냅니다. 실제로는 훨씬 더 높은 온도가 필요하지만, 더 낮은 온도에서도 암모니아 합성이 가능했던 것은 철을 기반으로 한 촉매를 사용해 반응 속도를 향상시켰기 때문이랍니다.
04
화학과 공학의 환상적 조합으로 ‘공기로 빵 만들기’ 성공!
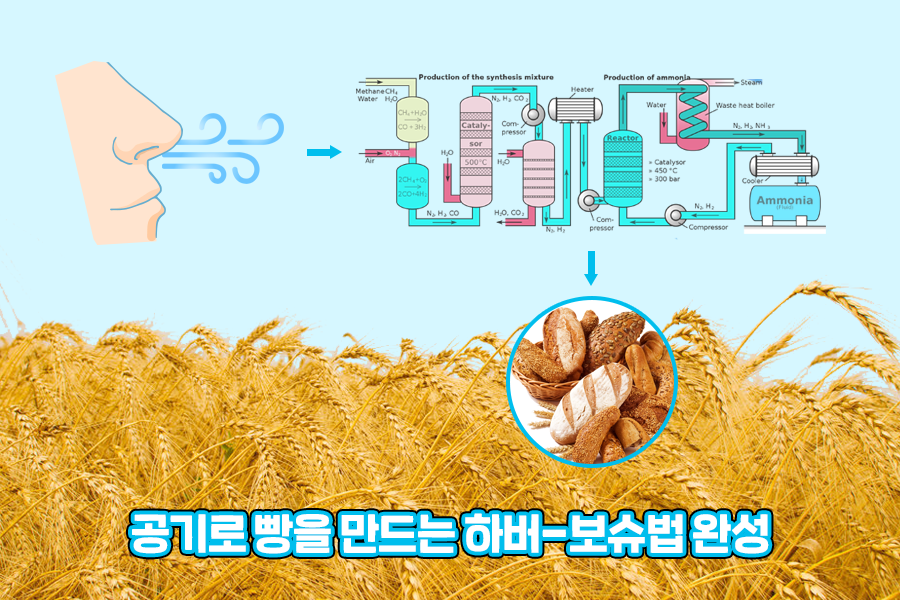
하버 박사가 발견한 암모니아 합성법이 실험실에서만 가능한 기술에서 끝나지 않고 많은 사람들이 이용할 수 있도록 널리 보급될 수 있었던 것은 카를 보슈(Karl Bosch) 박사의 역할이 컸습니다. 독일의 화학 회사 바스프(BASF) 연구소에서 일하던 보슈 박사는 최초의 하버법 공정에 사용되던 촉매인 오스뮴이 흔한 원소가 아닌 한계를 극복하기 위해 더 적합한 촉매를 개발하기 위한 여러 실험을 거듭하였습니다.
많은 종류의 금속을 시험해가며 오스뮴에서 우라늄, 그리고 1909년에는 드디어 가격이 훨씬 저렴한 철 기반의 촉매를 개발하기에 이릅니다. 고온 고압의 조건에서 철 촉매를 이용해 암모니아를 대량 생산해낼 수 있는 이 실용적인 공정은 두 화학자의 이름을 따서 하버-보슈법이라고 부르게 되었습니다.
하버-보슈법으로 인해 공기에 풍부한 질소 기체로부터 식물세포가 이용할 수 있는 암모니아 비료를 대량으로 만들 수 있게 되었고, 농업 생산력이 비약적으로 발전하면서 그야말로 공기로 빵을 만들어낼 수 있게 되었죠. 그리고 100년이 넘는 오늘날까지도 전세계 인류 절반이 먹을 곡물 생산에 쓰이고 있습니다.
훗날엔 이 방법이 세계1차대전의 탄약과 독가스 생산에 쓰이면서 많은 이의 목숨을 앗아간 비극적인 사건도 있었습니다. 그럼에도 불구하고 농업 생산 기술을 획기적으로 향상시켜 인류가 80억명으로 불어난 지금까지도 배고프지 않게 먹여 살릴 수 있었던 것은 하버 박사와 보슈 박사의 공헌 덕분입니다.
오늘은 화학과 공학이 만나 인류를 식량 위기에서 구할 수 있었던 하버-보슈법에 대해 알아보았습니다. 현재는 전쟁과 기후위기로 식량 위기가 다시 대두되고 있는데요, 전 인류의 평화와 환경의 가치를 지키기 위해 우리 모두가 발벗고 나서야 할 때인 것 같습니다. 무엇보다도 하루 빨리 종전 소식을 접할 수 있기를 바라며 마무리하겠습니다.
종합 케미칼 & 에너지 리더,
한화토탈에너지스에 대해 더 알고 싶다면?
'ChemiLOG' 카테고리의 다른 글
| [월간 화학] 유리보다 더 투명하고 강한 플라스틱, 플렉시글라스 (0) | 2022.06.29 |
|---|---|
| 석유화학의 심장, NCC 공정 (0) | 2022.06.16 |
| 탄소 중립에 한 걸음 가까이, CCUS 이야기 (0) | 2022.05.31 |
| [월간 화학] 연금술과 근대화학Ⅱ(원소와 원자 이야기) (0) | 2022.05.26 |
| 화학 반응의 규칙과 에너지 변화 (0) | 2022.05.12 |







