
분광학이란 물질과 전자기 방사선 사이의 상호작용에 관한 연구를 총칭하는 말입니다. 분광학은 프리즘을 통해 분리된 가시광선에 관한 연구에서 시작하여 물질과 방사 에너지 간 상호작용을 파장 또는 진동수의 함수로서 구성하는 것으로 점차 확장되어 왔는데요. 이러한 분광학적 특성을 활용하면 물질의 다양한 정보를 얻을 수 있으므로 다양한 분야에서 그 이용이 확대되어 가는 추세입니다.
오늘은 분광학의 기본적인 내용과 함께 분광학이 고분자 분석에서 어떠한 방식으로 응용될 수 있는지 알려드리겠습니다.
01
빛의 특성 이해하기

분광 분석법은 고분자의 구조와 물성을 연구하기 위한 효과적인 분석 방법입니다. 물질에 빛을 내리쬘 때, 물질을 구성하는 원자 또는 분자, 이온은 빛의 영향을 받습니다. 즉, 흡수, 방출, 산란 등 다양한 빛과 물질 간의 상호작용이 발생한다는 뜻이죠. 이를 이용하면 원자나 분자의 정성 및 정량적 특성과 물리적 특성을 알 수 있습니다.
여기서 말하는 상호작용을 이해하기 위해서 우리는 먼저 빛의 특성에 대해 알아보아야 합니다. 빛은 파장, 주파수, 속도, 진폭으로 표현되는 파동성과 에너지 매개 입자인 광자라는 입자성을 동시에 가지고 있습니다. 따라서 이러한 빛 알맹이 하나의 에너지는 다음과 같습니다.
E=hυ=hc/λ
즉, 파장 λ이 길수록(진동수 υ가 작을수록) 에너지가 작고, 파장 λ이 짧을수록(진동수 υ가 클수록) 에너지가 크다는 것을 알 수 있습니다. 그러므로 쬐어주는 빛의 파장에 따라 분자에 미치는 영향이 달라집니다.
02
빛과 물질 간 상호작용, 에너지 전이

앞서 잠깐 언급한 것처럼 빛이 물질과 상호작용을 하면 반사, 산란, 공명, 흡수, 형광 및 각종 광화학적 반응이 일어납니다. 이러한 상호작용은 에너지의 전이로 설명할 수 있는데요. 원자나 분자가 낮은 에너지 상태에서 높은 에너지 상태(들뜬 상태, excited state)가 되려면 그 에너지 차이에 해당하는 빛 알갱이를 흡수해야 하고, 높은 에너지 상태에서 낮은 에너지 상태로 전이될 때는 그 에너지 차이에 해당하는 빛을 방출하게 됩니다.
모든 입자는 고유한 특정 에너지 상태에 놓여 있는데요. 이를, 에너지 준위라고 합니다. 광자(빛의 입자)의 에너지는 입자의 들뜬 상태(excited state)와 바닥 상태(ground state)의 에너지 준위가 일치할 때 흡수가 일어납니다.
이 흡수 에너지는 각 화학종의 고유한 값입니다. 따라서 흡수된 복사선의 주파 연구는 시료* 성분을 알아내는 데 유용하며, 물질로부터 어떤 정보를 얻고 싶은지에 따라 사용하는 빛의 파장이 달라져야 합니다.
*시료: 시험, 검사, 분석 따위에 쓰는 물질이나 생물.
03
Beer의 법칙과 Lambert의 법칙
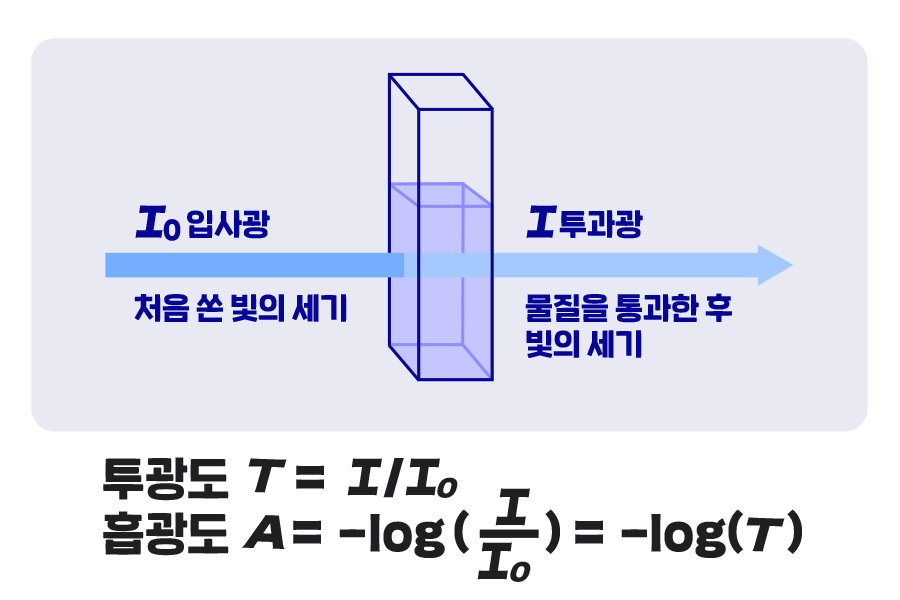
빛이 물질을 통과할 때 그 일부는 물질에 흡수될 수 있으며, 흡수되지 않고 통과한 나머지 빛은 검출기에 도달하게 됩니다. 분광기는 처음 쏜 빛의 세기(I0, 입사광)와 검출기에 도달한 빛의 세기(I, 투과광)를 비교하여 빛이 물질을 얼마나 통과했는지 검출하는 장치입니다. 빛이 물체를 뚫고 들어가는 정도를 나타내는 투광도(transmittance, T)는 처음 빛의 세기(I0)와 검출된 빛(I)의 분율로 표현됩니다.
투광도 T=I/I0
이 투광도를 이용하여 물질이 빛을 흡수한 정도인 흡광도(absorbance, A)를 다음과 같이 정의할 수 있습니다.
흡광도 A=-log(I/I0 )= -log(T)
흡광도와 물질의 몰농도 사이의 관계를 나타내는 법칙은 Beer의 법칙이라고 합니다. 흡광도(A)는 물질 내 빛을 흡수하는 화학종의 몰농도(c)에 따라 선형으로 비례하여 달라집니다. 따라서 물질 내 화학종의 농도를 예측하는데(정량분석) 흡광도를 사용할 수 있습니다.
또한, 흡광도는 빛이 물질을 통과하는 길이(path length)에 따라서도 달라지는데요. 이것을 Lambert의 법칙이라고 합니다. 빛이 물질을 통과해야 하는 길이(b)가 길어질수록 흡광도는 높아집니다.
04
Beer-Lambert의 법칙

우리는 앞서 농도와 빛의 통과 길이에 대한 흡광도의 두 법칙에 대해 알아보았습니다. 이 두 법칙을 조합한 것을 Beer-Lambert 법칙이라고 하며 그 식은 아래와 같습니다.
흡광도 A= εbc
여기서 ε는 몰 흡광 계수(molar absorptivity)를 뜻하는데요. 이는 물질마다 가지고 있는 고유한 값입니다. 몰 흡광 계수가 크다는 것은 물질이 빛을 잘 흡수한다는 것을 의미합니다.
만약 물질의 농도를 정확하게 알고 있다면, 흡광도를 측정하여 그 물질의 몰 흡광 계수를 알아낼 수 있습니다. 또한, 그 반대로 몰 흡광 계수를 아는 물질의 흡광도를 측정하여, 미지의 농도 값을 찾아낼 수도 있습니다.
05
분광학 응용하기, 적외선 분광학
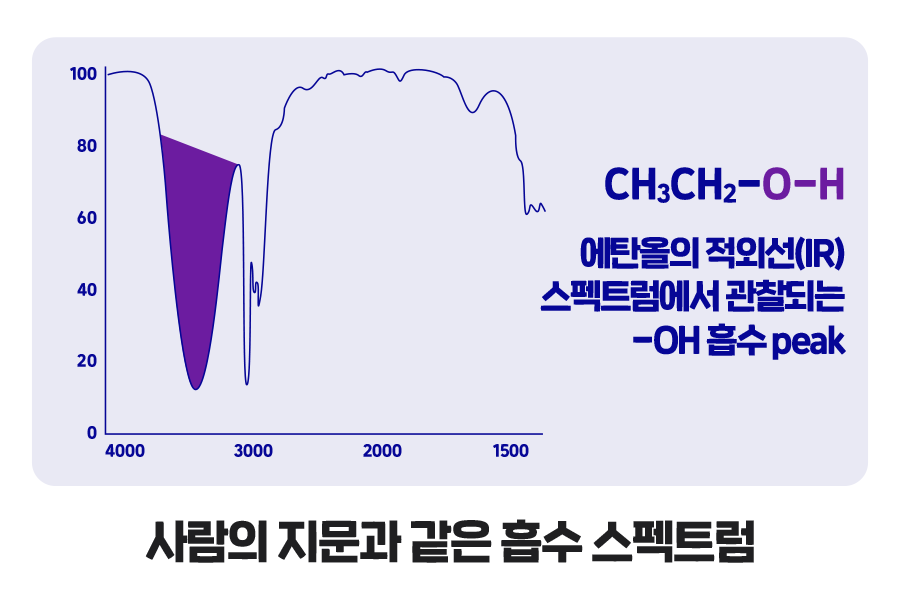
적외선 분광학은 진동 분광학(vibrational spectroscopy)의 한 종류로 고분자 분석에 널리 사용되는 대표적인 분석법입니다. 고분자 시료가 적외선에 노출되면 진동 전이의 선택 규칙에 따라 어떤 파장의 에너지는 흡수되며, 어떤 파장은 통과하게 됩니다. 앞서 설명한 것처럼 흡수 에너지는 각 화학종의 진동에 의한 고유한 값이므로 여기서 얻어지는 신호는 마치 사람의 지문과 같이 서로 다른 화학 구조에 따라 각기 다른 흡수 스펙트럼을 형성합니다. 이러한 이유로 적외선 분광학을 통해 고분자 화합물의 유형, 작용기의 종류, 치환기의 수와 위치 등에 대한 풍부한 구조적 정보를 얻을 수 있습니다.
대부분의 작용기는 독특한 적외선 IR(Infrared Ray, 적외선) 흡수 띠를 가지며, 특정 작용기가 어디서 흡수하는지를 앎으로써 IR 스펙트럼으로부터 구조적 정보를 얻어 해당 시료가 어떤 물질인지 확인하는 정성 분석에 활용할 수 있습니다. 또한, 앞서 설명한 Beer-Lambert 법칙을 응용하면 특정 흡수 정점(peak)의 흡광 정도(intensity)를 이용하여 해당 작용기를 포함한 물질의 정량 분석이 가능합니다.
오늘은 물질과 전자기 방사선 사이의 상호작용에 대해 연구하는 학문, 분광학에 대해 알아보았는데, 어떠셨나요? 어렵게만 느껴졌던 개념들이 조금은 알기 쉽게 다가갔기를 바랍니다. 그러면 다음에는 더욱 유익한 이야기로 돌아오겠습니다.
(글 : 한화토탈 분석연구팀 장결)
종합 케미칼 & 에너지 리더,
한화토탈에 대해 더 알고 싶다면?
'ChemiLOG' 카테고리의 다른 글
| 대한민국 달콤함의 대표주자, 달고나 속 과학 (0) | 2021.10.13 |
|---|---|
| 전투식량부터 즉석식품까지, 생존식량의 모든것 (0) | 2021.10.01 |
| [케미X스토리] 휘발유는 어떻게 ‘무연’이 되었을까? (1) | 2021.09.24 |
| 오감을 자극하는 바삭바삭한 튀김의 과학 (0) | 2021.09.15 |
| 패션으로 재탄생한 석유화학, 프라이탁(FREITAG) 이야기 (0) | 2021.09.10 |







